Термин «ковалентная связь» был введен лауреатом Нобелевской премии по химии – Ирвингом Ленгмюром в 1919 году. Под ним понимается химическая связь между двумя атомами, обладающими электронами. Ковалентная связь образуется между неметаллами и имеет ряд отличительных черт. В чем же разница между ковалентной и ионной связью?
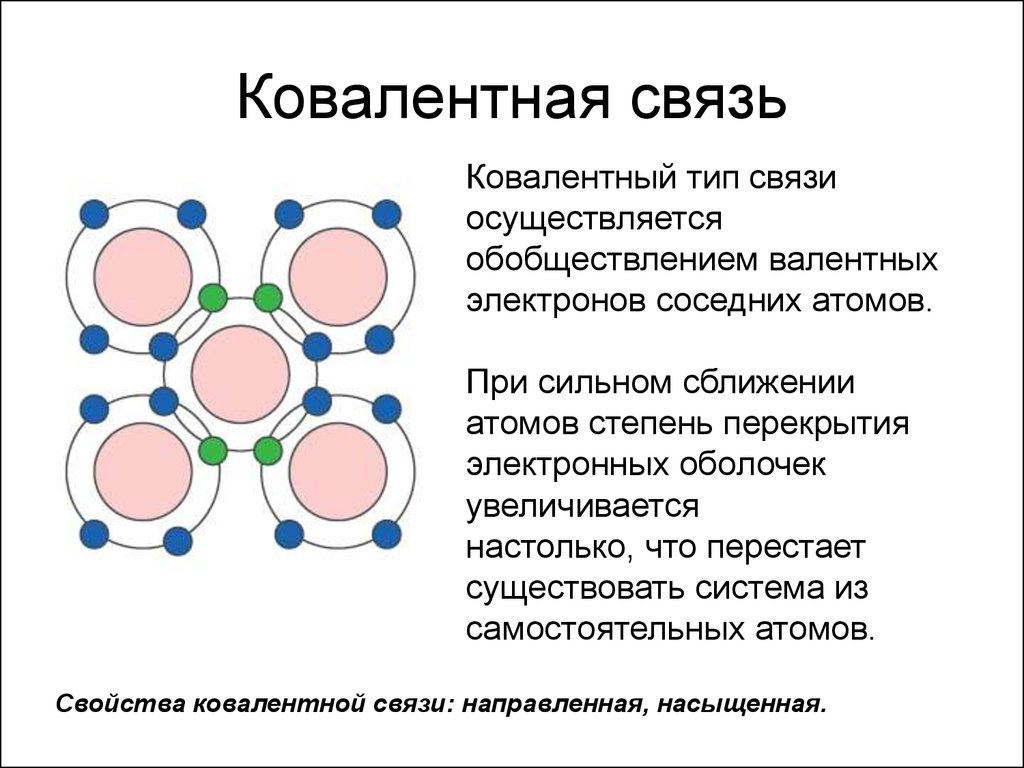
В химии выделяется два основных вида ковалентной связи: полярную и неполярную. Первая образуется между атомами различных неметаллов, вторая между атомами одного и того же химического элемента. Неполярная ковалентная связь характерна доя простых веществ, таких как C12, О2 и другие. Ковалентная связь считается наиболее общим видом химической связи.
Предельным случаем ковалентной полярной связи считается ионная связь. Она возникает между химическими элементами с очень сильно отличающимися показателями электроотрицательности. К примеру, ионная связь наблюдается между атомами щелочных металлов и галогенов. При сближении таких элементов валентные электроны одного атома полностью переходят на второй атом. Как следствие, оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Допустим, в результате взаимодействия атомов натрия и хлора появляются ионы Na+ и Cl- с электростатическим напряжением.
Взаимодействие отрицательных и положительных ионов не зависит от направления, а кулоновские силы не обладают свойством насыщенности.
Ионная связь, как правило, рассматривается через классические законы электростатики. В чистом виде данный вид ковалентной связи встречается только у веществ в парообразном состоянии. Положительные и отрицательные ионы связаны электростатическими силами и располагаются рядами. К каждому иону притягивается такое количество ионов противоположного знака, чтобы их хватило для образования кристаллической решетки. Следует отметить, что в ионном кристале нет молекул. При переходе вещества в жидкое состояние путем плавления или растворения, положительные и отрицательные ионы переходят в полученное вещество.
Необходимо упомянуть, что ионная связь отличается повышенной прочностью. Для разрушения ионного кристалла требуются внушительные затраты энергии. Кроме того, ионные соединения характеризуются высокими температурами плавления.
Ключевым отличием ионной связи является отсутствие свойств направленности и насыщаемости. Ионы создают электрическое поле со сферической симметрией. Такое поле идентично воздействует на каждый ион, поэтому их число и пространственное расположение определяется исключительно размером и величиной заряда.
Выводы:
- В химии выделяется два основных вида ковалентной связи: полярную и неполярную.
- Ионная связь – это предельный случай ковалентной связи.
- Ионная связь встречается только у веществ в парообразном состоянии.
- Ключевым отличием ионной связи является отсутствие свойств направленности и насыщаемости.
- Ионная связь отличается повышенной прочностью.